在健康细胞中,蛋白质的生成与清除处于微妙而精确的动态平衡之中。作为维持蛋白质稳态的核心装置,蛋白酶体负责识别并降解那些已损伤、错误折叠或不再需要的蛋白质。通过对底物蛋白泛素标记进行定向清除,蛋白酶体能有效阻止有毒蛋白聚集的堆积,守护细胞最基本的运行秩序。
然而,一旦蛋白酶体的功能出现失衡,细胞内部的蛋白质清除系统便会随之紊乱。未能及时被处理的错误折叠蛋白会不断积累,最终形成难以逆转的病理沉积。这一过程已被证实与多种神经退行性疾病的发生密切相关。
因此,深入理解蛋白酶体在真实细胞环境中的动态结构特征、互作网络及其在不同亚细胞区室内承担的差异化功能,是阐明神经退行性疾病发病机制的一个关键科学问题。而以往对蛋白酶体的结构研究大多在体外纯化条件下进行,并不能体现其在活细胞中的真实全貌。
2025年11月28日,北京大学化学与分子工程学院、北大-清华生命科学联合中心唐淳教授团队与中国科学院大连化学物理研究所张丽华团队,在Nature Communications 上发表题为《In-situ Cross-Linking Mass Spectrometry Reveals Compartment-Specific Proteasomal Interactions and Structural Heterogeneity》的研究论文,首次利用原位交联质谱技术,在完整细胞环境中系统解析了人源26S蛋白酶体在不同亚细胞区室(细胞核与细胞质)的构成差异、互作网络与结构动态特征。
研究团队开发并运用了一种细胞膜渗透性的交联剂,成功在活细胞内对蛋白酶体及其相互作用蛋白进行“冻结”和“拍照”。由于利用了细胞内蛋白质的极高浓度,这种方法能捕获到传统方法难以观察到的微弱、瞬时的相互作用。
研究团队设计并采用了 “两步富集”的策略:首先通过亲和纯化富集蛋白酶体复合物,随后再利用点击化学对交联肽段进行二次富集。这一策略显著降低了背景噪音,为后续的高精度质谱分析奠定了基础。
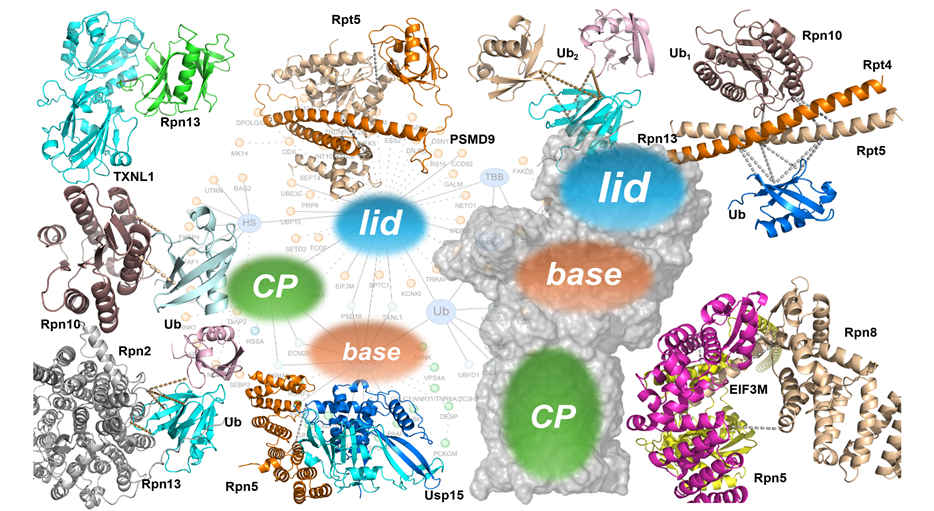
为了确保所发现的区室差异是真实的生物学现象而非技术误差,研究团队进行了系统而严谨的多层次数据质控。这包括在技术重复和生物学重复中评估交联肽段的重复性,并在母离子色谱峰强度及其保留时间、MS1信号和谱图数量等多个水平上对细胞核与细胞质的数据进行比对。结果显示,蛋白酶体在不同亚细胞区室中呈现出显著的组成差异和构象多样性,同时伴随独特的互作组和动态状态。
研究团队不仅鉴定到新的与泛素相关的蛋白酶体亚基,还发现了区室特异性的泛素结合模式和泛素化特征。这些差异提示蛋白酶体在细胞核与胞质中可能降解不同类型的底物,执行着截然不同的蛋白质稳态调控策略。
在此基础上,研究者进一步鉴定出多种此前未被报道的蛋白酶体互作因子,其中包括去泛素化酶USP15。此外,研究还揭示了一种新型“嵌合蛋白酶体”变体:翻译起始因子EIF3M替代了亚基Rpn9。
该项工作所建立的原位交联质谱技术框架,不仅揭示了亚细胞区室特异的结构与互作如何共同调控蛋白酶体功能,其系统性的质控方法和数据分析流程,也为利用化学交联技术在高背景的细胞内环境中获取高可信度相互作用数据树立了新标准,为深入理解细胞蛋白质稳态的精细调控机制及相关疾病研究提供了新的理论依据和技术支撑。
本论文的共同通讯作者为北京大学化学与分子工程学院、北大-清华生命科学联合中心唐淳教授、中国科学院大连化学物理研究所张丽华研究员与赵群研究员;共同第一作者包括中国科学院大连化学物理研究所赵丽丽,北京大学化学与分子工程学院赵润涛,以及中国科学院精密测量科学与技术创新研究院龚洲。本研究工作还受到了科技部重点研发计划和基金委重大就计划项目的支持。
文章链接:https://www.nature.com/articles/s41467-025-65752-6